Việt Nam cân nhắc sử dụng lại vắc xin Quinvaxem
Sau gần 3 tháng tạm dừng sử dụng vắc xin Quinvaxem, Việt Nam có thể cân nhắc sử dụng lại vắc xin này trong chương trình tiêm chủng mở rộng, do Tổ chức Y tế thế giới đã kiểm định vắc xin an toàn và kiến nghị Việt Nam sử dụng lại vắc xin này.
Ngày 19/6, ông Nguyễn Văn Bình, Cục trưởng Cục Y tế dự phòng (Bộ Y tế) cho biết, Tổ chức Y tế thế giới (WHO) đã có thông báo chính thức về kết quả kiểm định an toàn đối với vắc xin Quinvaxem trong chương trình tiêm chủng mở rộng của Việt Nam.
Theo đó, Tổ chức Y tế thế giới chính thức có thư gửi Bộ trưởng Bộ Y tế Việt Nam thông báo về kết quả kiểm định an toàn đối với vắc xin Quinvaxem do Berna Biotec, Hàn Quốc sản xuất. Kết quả kiểm định độc lập được thực hiện bởi Viện Quốc gia Kiểm định vắc xin và sinh phẩm y tế, Vương quốc Anh, cho thấy vắc xin Quinvaxem sử dụng trong Chương trình Tiêm chủng mở rộng của Việt Nam là vắc xin an toàn, bảo đảm chất lượng, hiệu quả trong việc dự phòng 5 bệnh truyền nhiễm phổ biến cho trẻ em. Qua đó, WHO tiếp tục khuyến cáo sử dụng vắc xin Quinvaxem trong Chương trình tiêm chủng mở rộng quốc gia.
WHO cho biết, khi nhận được đề xuất của Việt Nam về việc kiểm định vắc xin nhằm xác định chất lượng một số lô vắc xin trong bối cảnh tạm dừng sử dụng Quinvaxem sau những trường hợp phản ứng sau tiêm chủng nặng và kiểm định chưa đạt chuẩn tại Viện Kiểm định Quốc gia Vắc xin và Sinh phẩm Y tế Việt Nam, WHO đã yêu cầu phòng thí nghiệm nêu trên tiến hành xét nghiệm về độc tố của kháng nguyên ho gà (đánh giá sự tăng cân của chuột thí nghiệm) trên các lô 1453037, 1453074 và 1453127 do Việt Nam gửi tới.
Phòng thí nghiệm theo yêu cầu của Tổ chức Y tế thế giới thuộc Viện Kiểm định chuẩn thức Quốc gia về Vắc xin vµ Sinh phẩm Y tế Vương Quốc Anh đã kiểm định và kết quả kiểm định chất lượng của các lô vắc xin đạt những tiêu chuẩn theo khuyến nghị của Tổ chức Y tế thế giới đối với từng kháng nguyên Bạch hầu, Uốn ván, Ho gà và vắc xin phối hợp.
WHO cũng chia sẻ, trước đó, cuộc họp ngày 12/6/2013 của Ủy ban Tư vấn toàn cầu về an toàn tiêm chủng đã đánh giá tính an toàn của vắc xin 5 trong 1 đưa ra kết luận như sau “Việc triển khai vắc xin phối hợp 5 trong 1 tại các nước Đông Nam Á cho thấy ảnh hưởng của các phản ứng sau tiêm chủng đã trở thành thách thức rất lớn đối với các nhà hoạch định chính sách. Đánh giá chi tiết từng trường hợp tại 4 quốc gia có sự tham gia của các chuyên gia quốc tế đã thống nhất kết luận về nguyên nhân từng trường hợp phản ứng sau tiêm chủng của các quốc gia này và việc triển khai lại vắc xin 5 trong 1 tại Srilanca và Bhutan là những bài học quý giá về thành công của hệ thống giám sát quốc gia về an toàn tiêm chủng. Vắc xin phối hợp 5 trong 1 đã mang lại những lợi ích to lớn trong việc bảo vệ phòng chống 5 bệnh truyền nhiễm nguy hiểm chỉ với 1 liều vắc xin. Hiện nay vắc xin phối hợp 5 trong 1 được sản xuất tại 5 công ty đạt tiêu chuẩn Tiền thẩm định của WHO đảm bảo về tính an toàn, hiệu quả và chất lượng.
Từ đó, WHO khuyến cáo các quốc gia tiếp tục sử dụng vắc xin Quinvaxem trong Chương trình Tiêm chủng mở rộng. Trước đề nghị này của WHO, ngày mai (20/6), Bộ Y tế sẽ tổ chức cuộc họp báo để thông báo về vụ việc cũng như đưa ra “phán quyết” có tiếp tục sử dụng lại vắc xin Quinvaxem trong chương trình tiêm chủng mở rộng hay không.
Trước đó, trả lời về việc tạm dừng vắc xin Quinvaxem trong chương tình tiêm chủng mở rộng tại Việt Nam, Bộ trưởng Bộ Y tế Nguyễn Thị Kim Tiến khẳng định: “Liên quan đến các trường hợp phản ứng sau tiêm chủng, dù chưa có bằng chứng chứng minh các trường hợp tử vong có liên quan đến vắc-xin, các trường hợp tử vong trên có thể là sự trùng hợp vì tỷ lệ tử vong của trẻ dưới 1 tuổi tại Việt Nam là 15,8 %o, hoặc do các bệnh khác như viêm phổi, tim mạch,… nhưng để thận trọng hơn và đảm bảo an toàn tối đa cho tiêm chủng, Bộ Y tế quyết định tạm dừng sử dụng vắc-xin Quinvaxem (dự kiến trong khoảng 3 tháng) để các cơ quan chuyên môn phối hợp với Tổ chức Y tế thế giới, Quỹ nhi đồng liên hợp quốc và các nhà khoa học khác trên thế giới tiến hành đánh giá tổng thể về vắc-xin này ở Việt Nam và gửi các lô vắc-xin sang phòng kiểm định độc lập tại nước Anh để kiểm định lại chất lượng vắc-xin”, bà Tiến khẳng định.
Theo đó, 3 tháng đầu năm 2013, toàn quốc ghi nhận 5 trường hợp tử vong sau tiêm. Theo kết luận của Hội đồng tư vấn chuyên môn đánh giá tai biến trong quá trình sử dụng vắc-xin, sinh phẩm y tế, trong số 5 trường hợp tử vong nêu trên có 4 trường hợp không liên quan đến tiêm chủng và chất lượng vắc-xin, 1 trường hợp chưa chẩn đoán được nguyên nhân tử vong.
Theo nữ Bộ trưởng này, việc tạm dừng sử dụng vắc xin là một thực hành thông thường trong chương trình tiêm chủng mở rộng. Trước đây vào năm 2012, Bộ Y tế đã cho tạm dừng sử dụng một lô vắc-xin Quinvaxem trên phạm vi toàn quốc do nghi ngờ vắc-xin có liên quan đến phản ứng nặng sau tiêm. Thời gian tạm dừng sử dụng trong 1-3 tháng không ảnh hưởng đến đáp ứng miễn dịch của trẻ.
Theo Dân Trí
Mới hơn
- CHÍNH PHỦ, BỘ Y TẾ CẦN XIN BẠN MỘT STATUS TRÊN FACEBOOK CỦA BẠN!
- Dịch COVID-19: WHO khuyến cáo chuẩn bị cho nguy cơ xảy ra một đại dịch
- Sơn La lưu ý phòng, chống bệnh sán dây, ấu trùng sán lợn trong nhà trường
- Công bố kết quả kiểm nghiệm vụ hàng trăm trẻ em nhiễm sán: Mẫu thịt gà an toàn, nguồn thịt lợn đủ điều kiện
- Công ty nghi cung cấp thịt lợn nhiễm sán đăng ký rất nhiều ngành nghề
- Vô tình xem camera an ninh, bàng hoàng thấy bạn đang giở trò đồi bại với con gái mình
- LƯƠNG Y NGUYỄN BÁ NHO KHẮC TINH CỦA BỆNH UNG THƯ
- Thầy thuốc đến từ Đề án 1816 hiến máu cứu người bệnh
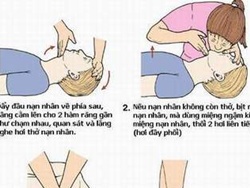
- Cách hô hấp nhân tạo và xoa bóp tim ngoài lồng ngực
- 65 năm chiến sĩ áo trắng
- Chiến thắng nỗi đau
- “Bắt bệnh” cho người chết
- “Giàng y tế” ở A Bung
- “Trái tim Đankô” của thầy thuốc làng HIV/AIDS
- Thần y trong nhà lao Côn Đảo
- Thành công từ ý chí và sự vươn lên không mệt mỏi
- Người bác sĩ giàu lòng nhân ái và sáng tạo
- Ở nơi “hạn hán nụ cười”
- Người Giàng
- “Hoa Đà” trên Cao nguyên đá
- Đông y và các bệnh thường gặp mùa lạnh
- Bệnh gút và điều trị gút trong đông y
- Bệnh nhồi máu cơ tim và bài thuốc chữa từ đông y
- Đông y điều trị rối loạn nhịp tim
- Chữa trĩ bằng Đông y
- Tự chữa bệnh trĩ bằng Đông y
- Đông y trị bệnh đau mắt đỏ
- Chữa trị rối loạn tiền đình theo Đông y
- Đông y trị chứng hoa mắt chóng mặt
- Khí công
- Mai hoa châm
Liên hệ với chúng tôi
Thời tiết hôm nay