Ngừng sử dụng 2 lô vắc-xin liên quan đến 3 trẻ tử vong
Chiều 22/7, ông Trương Quốc Cường, Cục trưởng Cục Quản lý Dược (Bộ Y tế) cho biết, Cục vừa ra thông báo về việc tạm ngừng sử dụng trên toàn quốc 2 lô vắc-xin viêm gan B liên quan tới sự cố sau sử dụng tại tỉnh Quảng Trị vừa qua.
Theo Cục Quản lý Dược, liên quan đến sự cố sau sử dụng đối với các lô vắc-xin viêm gan B, căn cứ vào các quy chế dược hiện hành của Việt Nam và để đảm bảo an toàn cho người sử dụng, Cục Quản lý dược thông báo tạm ngừng việc sử dụng các lôvắc-xin viêm gan B, số lô: V-GB020812E và V-GB030812E, hạn dùng: 07/2015, số đăng ký: QLVX-0376-11.
Hai lô vắc-xin bị tạm dừng sử dụng trên do Công ty trách nhiệm hữu hạn MTV Vắcxin và Sinh phẩm Y tế số 1 (Vabiotech) sản xuất.
Bên cạnh đó, Cục Quản lý Dược yêu cầu Dự án tiêm chủng mở rộng quốc gia phối hợp với Công ty trách nhiệm hữu hạn MTV Vắc xin và Sinh phẩm Y tế số 1 (Vabiotech): Gửi thông báo tạm ngừng sử dụng tới những nơi phân phối, sử dụng các lô vắc-xin viêm gan B trên và yêu cầu các đơn vị này bảo quản theo đúng điều kiện quy định ghi trên nhãn của vắc-xin.
Cục Quản lý Dược yêu cầu Sở Y tế các tỉnh, thành phố trực thuộc Trung ương, Y tế các ngành, các Trung tâm y tế dự phòng tỉnh, thành phố trực thuộc Trung ương thông báo cho các cơ sở kinh doanh, sử dụng vắc-xin tạm ngừng sử dụng các lô vắc-xin trên; thực hiện việc bảo quản theo đúng điều kiện quy định ghi trên nhãn và kiểm tra, giám sát các đơn vị thực hiện thông báo này. Cục Quản lý dược thông báo và yêu cầu các đơn vị nghiêm túc, khẩn trương thực hiện.
3 trẻ sơ sinh tử vong do sốc phản vệ sau tiêm chủng
Chiều 22/7, đoàn công tác của Bộ Y tế do GSTS Nguyễn Trần Hiển, Trưởng Ban quản lý dự án tiêm chủng mở rộng Quốc gia, đã có buổi làm việc với lãnh đạo và các cơ quan chức năng của tỉnh Quảng Trị để tìm nguyên nhân 3 trẻ sơ sinh bị tử vong sau khi tiêm vắc-xin viêm gan B tại bệnh viện Đa khoa huyện Hướng Hoá, tỉnh Quảng Trị.khi tiêm vắc-xin viêm gan B tại bệnh viện Đa khoa huyện Hướng Hóa, tỉnh Quảng Trị.
Sau cuộc họp kín về chuyên môn, Giám đốc Sở y tế tỉnh Quảng Trị Trần Văn Thành đã công bố kết luận ban đầu của Hội đồng. Theo đó, nguyên nhân tử vong của 3 trẻ sơ sinh là do sốc phản vệ chưa rõ nguyên nhân. Đoàn công tác đề nghị gửi mẫu vắc-xin, mẫu nghiệm (máu, mô phổi, não, gan, thận, tim) đến phòng thí nghiệm quốc gia, quốc tế để xét nghiệm kiểm định chất lượng vắc-xin và các chất lạ có trong mẫu nghiệm.
Cũng theo kết luận của Hội đồng, toàn quốc có khoảng 600.000 liều thuộc 2 lô này đã được sử dụng mà không có báo cáo một trường hợp phản ứng nào. Vắc-xin được kiểm định có giấy phép xuất xưởng của Viện kiểm định quốc gia vắc-xin và sinh phẩm y tế. Qua kiểm tra đoàn công tác xác định công tác quản lý vắc xin tại bệnh viện chưa đúng theo quy định; không ghi chép quản lý vắc-xin hàng ngày; không lưu vỏ, lọ theo quy định; không triển khai tiêm vắc-xin tại phòng tiêm riêng mà tiêm tại phòng bệnh.
Theo VNmedia
Mới hơn
- CHÍNH PHỦ, BỘ Y TẾ CẦN XIN BẠN MỘT STATUS TRÊN FACEBOOK CỦA BẠN!
- Dịch COVID-19: WHO khuyến cáo chuẩn bị cho nguy cơ xảy ra một đại dịch
- Sơn La lưu ý phòng, chống bệnh sán dây, ấu trùng sán lợn trong nhà trường
- Công bố kết quả kiểm nghiệm vụ hàng trăm trẻ em nhiễm sán: Mẫu thịt gà an toàn, nguồn thịt lợn đủ điều kiện
- Công ty nghi cung cấp thịt lợn nhiễm sán đăng ký rất nhiều ngành nghề
- Vô tình xem camera an ninh, bàng hoàng thấy bạn đang giở trò đồi bại với con gái mình
- LƯƠNG Y NGUYỄN BÁ NHO KHẮC TINH CỦA BỆNH UNG THƯ
- Thầy thuốc đến từ Đề án 1816 hiến máu cứu người bệnh
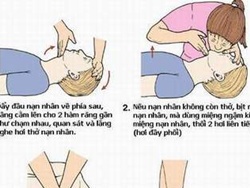
- Cách hô hấp nhân tạo và xoa bóp tim ngoài lồng ngực
- 65 năm chiến sĩ áo trắng
- Chiến thắng nỗi đau
- “Bắt bệnh” cho người chết
- “Giàng y tế” ở A Bung
- “Trái tim Đankô” của thầy thuốc làng HIV/AIDS
- Thần y trong nhà lao Côn Đảo
- Thành công từ ý chí và sự vươn lên không mệt mỏi
- Người bác sĩ giàu lòng nhân ái và sáng tạo
- Ở nơi “hạn hán nụ cười”
- Người Giàng
- “Hoa Đà” trên Cao nguyên đá
- Đông y và các bệnh thường gặp mùa lạnh
- Bệnh gút và điều trị gút trong đông y
- Bệnh nhồi máu cơ tim và bài thuốc chữa từ đông y
- Đông y điều trị rối loạn nhịp tim
- Chữa trĩ bằng Đông y
- Tự chữa bệnh trĩ bằng Đông y
- Đông y trị bệnh đau mắt đỏ
- Chữa trị rối loạn tiền đình theo Đông y
- Đông y trị chứng hoa mắt chóng mặt
- Khí công
- Mai hoa châm