Ðình chỉ lưu hành một số thuốc sản xuất không đúng số đăng ký
Ngày 10/7/2013, Cục Quản lý Dược đã có Công văn số 10947/QLD-CL thông báo đình chỉ lưu hành trên toàn quốc mặt hàng thuốc S-valapro (viên bao tan trong ruột valproate 200mg), SĐK: VN- 8549-09 do Công ty cổ phần xuất nhập khẩu y tế TP. Hồ Chí Minh Yteco nhập khẩu và thuốc viên nén cefixime 200mg, SĐK: VN- 7563-09 do Công ty cổ phần y dược phẩm Vimedimex nhập khẩu. Các thuốc trên do Công ty AMN Life Science Pvt Ltd- India sản xuất không đúng hồ sơ đăng ký thuốc đã được Bộ Y tế xét duyệt. Thuốc do Công ty TNHH dược phẩm Tường Nghi đăng ký.
Cục Quản lý Dược yêu cầu các đơn vị sản xuất, nhập khẩu, phân phối... phải tiến hành thu hồi 2 loại thuốc trên; Gửi báo cáo thu hồi, hồ sơ thu hồi các mặt hàng thuốc sản xuất không đúng hồ sơ đăng ký thuốc về Cục Quản lý Dược trước ngày 9/8/2013.
Trước đó, Cục Quản lý Dược đã có Công văn số 10788/QLD-CL đình chỉ lưu hành và thu hồi thuốc trên toàn quốc thuốc viên nén bao tan trong ruột diclofocal (diclofenac tablets B.P. 50mg), lô số: B620, HD: 19/6/2016, SĐK: VN-5689-10, do Công ty XL Laboratories Pvt, Ltd., India sản xuất, Công ty Cổ phần Y Dược phẩm Vimedimex TP.HCM nhập khẩu. Lô thuốc trên không đạt tiêu chuẩn chất lượng về chỉ tiêu định lượng và tạp chất liên quan theo BP 2010.
Cục Quản lý Dược yêu cầu Công ty CP Y Dược phẩm Vimedimex TP.HCM phối hợp với nhà cung cấp phải gửi thông báo thu hồi tới những nơi phân phối, sử dụng thuốc viên nén bao tan trong ruột diclofocal và tiến hành thu hồi toàn bộ lô thuốc không đạt tiêu chuẩn chất lượng nêu trên; Gửi báo cáo thu hồi, hồ sơ thu hồi thuốc không đạt tiêu chuẩn chất lượng về Cục Quản lý Dược trước ngày 10/8/2013.
Theo SKDS
Mới hơn
- LƯƠNG Y NGUYỄN BÁ NHO KHẮC TINH CỦA BỆNH UNG THƯ
- Thầy thuốc đến từ Đề án 1816 hiến máu cứu người bệnh
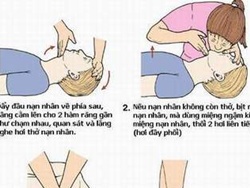
- Cách hô hấp nhân tạo và xoa bóp tim ngoài lồng ngực
- 65 năm chiến sĩ áo trắng
- Chiến thắng nỗi đau
- “Bắt bệnh” cho người chết
- “Giàng y tế” ở A Bung
- “Trái tim Đankô” của thầy thuốc làng HIV/AIDS
- Thần y trong nhà lao Côn Đảo
- Thành công từ ý chí và sự vươn lên không mệt mỏi
- Người bác sĩ giàu lòng nhân ái và sáng tạo
- Ở nơi “hạn hán nụ cười”
- Người Giàng
- “Hoa Đà” trên Cao nguyên đá
- Đông y và các bệnh thường gặp mùa lạnh
- Bệnh gút và điều trị gút trong đông y
- Bệnh nhồi máu cơ tim và bài thuốc chữa từ đông y
- Đông y điều trị rối loạn nhịp tim
- Chữa trĩ bằng Đông y
- Tự chữa bệnh trĩ bằng Đông y
- Đông y trị bệnh đau mắt đỏ
- Chữa trị rối loạn tiền đình theo Đông y
- Đông y trị chứng hoa mắt chóng mặt
- Khí công
- Mai hoa châm
Liên hệ với chúng tôi
Thời tiết hôm nay