Cập nhật thông tin mới nhất về thuốc chứa calcitonin dạng tiêm
Bộ Y tế (Cục Quản lý Dược) vừa có công văn gửi Sở Y tế các tỉnh, thành phố trực thuộc Trung ương; các bệnh viện...
Bộ Y tế (Cục Quản lý Dược) vừa có công văn gửi Sở Y tế các tỉnh, thành phố trực thuộc Trung ương; các bệnh viện, viện có giường bệnh trực thuộc Bộ Y tế và các công ty đăng ký, sản xuất thuốc lưu hành tại Việt Nam về việc cập nhật thông tin dược lý đối với thuốc chứa calcitonin dạng tiêm, đồng thời tăng cường việc theo dõi tác dụng không mong muốn của thuốc trong quá trình sử dụng và lưu hành.
Theo đó, về chỉ định dùng thuốc, cần loại bỏ các chỉ định đã được phê duyệt trước đây và thay thế bằng các chi định sau: phòng ngừa mất xương cấp tính do bất động đột ngột như trường hợp bệnh nhân bị gãy xương do loãng xương; điều trị bệnh Paget, giới hạn sử dụng cho bệnh nhân không đáp ứng với các phương pháp điều trị khác hoặc không phù hợp với các phương pháp điều trị khác như bệnh nhân có suy giảm chức năng thận nghiêm trọng; tăng calci máu ác tính.
Về liều dùng và cách dùng, cần bổ sung những thông tin sau: Dựa trên bằng chứng việc sử dụng lâu dài calcitonin làm tăng nguy cơ ung thư, thời gian điều trị ở tất cả các chỉ định cần được giới hạn ngắn nhất có thể và sử dụng mức liều tối thiểu có hiệu quả.
Để phòng ngừa mất xương cấp tính do bất động đột ngột như trường hợp bệnh nhân bị gãy xương do loãng xương, liều khuyến cáo 100 IU 1 lần/ngày hoặc 50 IU 2 lần/ngày tiêm dưới da hoặc tiêm bắp. Giảm liều xuống 50 IU 1 lần/ngày khi bệnh nhân bắt đầu có thể cử động. Đợt điều trị được khuyến cáo kéo dài 2 tuần, tối đa là 4 tuần do tăng nguy cơ ung thư khi sử dụng lâu dài calcitonin.
Đối với bệnh Paget, liều khuyến cáo 100 IU 1 lần/ngày tiêm dưới da hoặc tiêm bắp, tuy nhiên, mức liều tối thiểu 50 IU 3 lần/tuần vẫn có hiệu quả sinh hóa và lâm sàng. Mức liều nên được hiệu chỉnh phù hợp với tình trạng bệnh nhân. Việc điều trị nên kết thúc ngay sau khi bệnh nhân có đáp ứng và các triệu chứng thoái lui. Thời gian điều trị thông thường tối đa là 3 tháng. Trong trường hợp ngoại lệ như bệnh nhân có khả năng bị gãy xương bệnh lý, thời gian điều trị có thể kéo dài tối đa 6 tháng.
Việc tái điều trị định kỳ có thể tiến hành ở các bệnh nhân nói trên sau khi cân nhắc giữa lợi ích và việc tăng nguy cơ ung thư khi sử dụng lâu dài thuốc này. Hiệu quả của calcitonin có thể được theo dõi bằng cách đánh giá các dấu hiệu tái cấu trúc xương, chẳng hạn như hoạt độ alkalin phosphatase huyết thanh hoặc nồng độ hydroxyprolin hoặc deoxypyridinolin niệu...
Cục Quản lý Dược yêu cầu, đối với thuốc chứa calcitonin dạng tiêm đã được cấp phép lưu hành trên thị trường, trong vòng 3 tháng kể từ ngày ký công văn này, yêu cầu công ty đăng ký, nhà sản xuất tự cập nhật các thông tin dược lý liên quan đến thuốc này vào nhãn, tờ hướng dẫn sử dụng thuốc và hồ sơ liên quan và chịu trách nhiệm về các nội dung đã cập nhật. Trường hợp phát hiện các cơ sở sản xuất, kinh doanh không thực hiện cập nhật thông tin này, Cục Quản lý Dược sẽ đình chỉ lưu hành hoặc ngừng cấp số đăng ký thuốc theo quy định.
Đối với thuốc chứa calcitonin dạng tiêm đang chờ xét duyệt, Cục Quản lý Dược chỉ xem xét cấp số đăng ký lưu hành sau khi công ty đã nộp tài liệu sửa đổi/bổ sung các thông tin dược lý theo hướng dẫn kèm theo công văn này.
Theo SKDS
Mới hơn
- LƯƠNG Y NGUYỄN BÁ NHO KHẮC TINH CỦA BỆNH UNG THƯ
- Thầy thuốc đến từ Đề án 1816 hiến máu cứu người bệnh
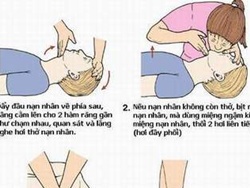
- Cách hô hấp nhân tạo và xoa bóp tim ngoài lồng ngực
- 65 năm chiến sĩ áo trắng
- Chiến thắng nỗi đau
- “Bắt bệnh” cho người chết
- “Giàng y tế” ở A Bung
- “Trái tim Đankô” của thầy thuốc làng HIV/AIDS
- Thần y trong nhà lao Côn Đảo
- Thành công từ ý chí và sự vươn lên không mệt mỏi
- Người bác sĩ giàu lòng nhân ái và sáng tạo
- Ở nơi “hạn hán nụ cười”
- Người Giàng
- “Hoa Đà” trên Cao nguyên đá
- Đông y và các bệnh thường gặp mùa lạnh
- Bệnh gút và điều trị gút trong đông y
- Bệnh nhồi máu cơ tim và bài thuốc chữa từ đông y
- Đông y điều trị rối loạn nhịp tim
- Chữa trĩ bằng Đông y
- Tự chữa bệnh trĩ bằng Đông y
- Đông y trị bệnh đau mắt đỏ
- Chữa trị rối loạn tiền đình theo Đông y
- Đông y trị chứng hoa mắt chóng mặt
- Khí công
- Mai hoa châm