Globulin miễn dịch
Lịch sử: năm 1940 "gamma globulin" (có nghĩa là IgE) được phân lập lần đầu tiên từ máu người bằng quá trình gọi là tách. Điều này thậm chí dẫn đến sử dụng globulin miễn dịch tiêm bắp (IMIGs) đối với miễn dịch thụ động để dự phòng và điều trị những bệnh do virus (ví dụ viêm gan A) và sau đó vào những năm 1950 để điều trị vô gamma globulin huyết. Globulin miễn dịch có thể tiêm tĩnh mạch (tức là IVIGs) được triển khai năm 1970 là một thuận tiện hơn, ít đau và là thay thế tác dụng nhanh cho IMIGs. Các quá trình tách ethanol ban đầu được dùng cho IMIGs cần tinh chế nhiều lần (có nghĩa là tách thêm và biến đổi hóa học hoặc làm tinh khiết) cho một sản phẩm tĩnh mạch.
Điều này làm tinh khiết IgG nhiều hơn, thêm chất bất hoạt, cung cấp IgG nguyên chất và ngăn ngừa liên kết chéo các mono IgG. Năm 1981, Gamimune (r) do Mile phân lập, là IVIGs đầu tiên được đăng ký ở Mỹ. Dạng không biến đổi đầu tiên của IVIGs (Sandoglobulin (r) hãng Sandoz) có ở thị trường năm 1984. Gamimune (r) được chuyển thành dạng không biến đổi năm 1986 và sản phẩm này được đổi tên thành Gamimuner (r) N. Sau đó, một số IVIGs khác được đăng ký ở Mỹ. Gammagard (r) do (Hyland), Polygam (r) (bởi hội chữ thập đỏ Mỹ) Iveegam (r) (bởi immuno Mỹ) Venoglobulin-I (r) (bởi alpha Therapeutic), và Gammar-IV (r) (bởi armor). Năm 1991, IVIGs sản phẩm dạng bột hoà tan lần đầu tiên được chấp nhận (Venoglobulin-S(r)). Năm 1994, sau một vụ dịch viêm gan C liên quan đến Gammagard (r), sản phẩm điều chế dạng bột không hoà tan (có nghĩa là Gammagard (r)) và Polygam(r) bị đình chỉ và Gammagard SD(r) và polygam SD (r) được đăng ký. Năm 1980, bệnh nhân dùng miễn dịch để điều trị đối với giảm gamma globulin huyết kèm ban xuất huyết giảm tiểu cầu tự phát (ITP) cho thấy có tăng số lượng tiểu cầu trong thời gian điều trị. Tiếp theo phát hiện ngẫu nhiên này, việc sử dụng IVIGs cho ITP được nghiên cứu và hiện nay nó được dùng cho chỉ định này. Kể từ khi IVIGs có hiệu quả đối với ITP, chúng tiếp tục được đánh giá về điều trị những bệnh khác với giả định cơ chế tự miễn. Các bác sĩ nên chú ý là hầu hết những dữ liệu ủng hộ việc sử dụng IVIGs đối với bệnh tự miễn (ví dụ bệnh Kawasaki, nhược cơ năng, bệnh đa thần kinh huỷ myelin viêm mạn tính, hội chứng Guillain-Barre và cơn co giật khó chữa trị) lấy từ các nghiên cứu không đối chứng hoặc thông báo từ các trường hợp. Không phải tất cả các IVIGs có dán nhãn chỉ định như nhau. Các chỉ định được thừa nhận (đối với bất cứ sản phẩm có tên thương mại được chấp nhận) bao gồm suy giảm miễn dịch tiên phát, (ITP), xuất huyết do giảm tiểu cầu tự phát, ngăn ngừa nhiễm khuẩn thụ động ở bệnh nhân có bạch cầu lympho mạn tính tế bào B (CLC), bệnh Kawasaki, ngăn ngừa nhiễm khuẩn thụ động ở trẻ em có AIDS và bệnh nhân thực hiện ghép tuỷ xương (BMT) để ngăn ngừa bệnh vật chủ không chấp nhận mảnh ghép. Các chỉ dẫn không được dán nhãn gồm rất nhiều các rối loạn tự miễn dịch, ngăn ngừa nhiễm khuẩn chu sinh và ngăn ngừa và điều trị nhiễm cytomegalovirus trong ghép tạng đặc và tuỷ xương.
Cơ chế tác dụng: ở bệnh nhân có suy giảm miễn dịch thứ phát và tiên phát, tác dụng có lợi của IVIGs là được giả định qua việc thay thế thiếu hụt hoặc loạn chức năng IgG. IVIGs cung cấp kháng thể dự trữ với các tác nhân gây bệnh thông thường ở môi trường. Tuy nhiên cơ chế của IVIGs đối với bệnh tự miễn dịch là không rõ ràng. Liều cao IGIVs dùng cho bệnh tự miễn có thể gây ra tác dụng ức chế miễn dịch chung, cung cấp các kháng thể kháng tự phát, hoặc gắn với các chất trung gian viêm nhiễm (ví dụ bổ thể). Năm 1990 Viện y học Quốc gia đồng ý thảo luận là cần có nghiên cứu lớn về cơ chế của nhiều loại bệnh mà IVIGs được sử dụng để điều trị. Cơ chế chính xác của IVIGs trong bệnh tự miễn dịch vẫn chưa được biết rõ.
Đặc điểm phân biệt: hầu hết các thày thuốc hiện nay cân nhắc về tính tương đương của các chỉ định dán và không được dán trên nhãn của các IVIGs sẵn có ở thị trường. Đặc điểm phân biệt quan trọng nhất là số lượng của IgA "ô nhiễm" có trong sản phẩm. Các đặc điểm dược lý khác (ví dụ: pH, nồng độ các protein khác hoặc đường, chất lỏng so với bột và liệu có hay không sản phẩm được điều chế dạng bột hoà tan) có thể khác nhau từ sản phẩm này đến sản phẩm khác. Do IVIGs có thể rất đắt, chi phí tương đối cũng là 1 đặc điểm phân biệt quan trọng. Bệnh nhân bị giảm gamma globulin huyết người bị nhạy cảm trung gian kháng thể với IgA phải dùng sản phẩm có hàm lượng IgA rất thấp. Gammagard SD (r) và Polygam SD (r), được sản xuất bằng qui trình tương tự có số lượng IgA thấp nhất là những sản phẩm sẵn có (có nghĩa là < 3,7m g) Tuy nhiên Iveegam (r) chứa < 2m g/ml IgA, sản phẩm này khó sản xuất. May mắn là bệnh nhân thiếu hụt gammaglobulin hiếm khi nhạy cảm với IgA.
Bệnh nhân bị giảm gamma globulin huyết có thể cũng bị nhạy cảm với các thành phần dược lý của 1 sản phẩm (ví dụ pepsin trong Sandoglobulin (r)). Những bệnh nhân này có thể cần loại sản phẩm đặc biệt của IVIGs để tránh mắc phải phản ứng bất lợi. May mắn thay, những bệnh nhân này cũng rất hiếm gặp. 1 sản phẩm IVIGs mà đã có sẵn ở dạng lỏng có thể được thích hơn ở một số tình trạng lâm sàng. Bột IVIGs hòa tan thành dung dịch rất chậm. Liều lớn IVIGs hòa tan có thể phải chuẩn bị hơn 30'. Thêm nữa, nếu IVIGs được lắc, protein có thể bị phá huỷ. 1 sản phẩm dạng dung dịch (ví dụ Gamimuse N(r)) có lợi khi cần liều nhanh hoặc khi dạng bột tái hình thành có thể sảy ra khi cố gắng chuẩn bị liều IVIGs khi đưa bệnh nhân đến cơ sở lâm sàng. Liệu việc điều trị dạng bột hoà tan là cần thiết đối với IVIGs hay không vẫn còn tranh cãi. Điều chế bột hoà tan IVIGs sẽ loại trừ nguy cơ của virus bao lipid (vd viêm gan C) nhưng sẽ không loại trừ nguy cơ của tất cả các loại virus (ví dụ parvo virus B-19). Tuy nhiên đã có một vài trường hợp viêm gan C liên quan đến IVIGs. Những người cho máu mà huyết thanh của họ được sử dụng để làm IVIGs hiện nay được sàng lọc kháng thể viêm gan C. Mỉa mai thay, loại trừ huyết thanh từ những bệnh nhân này thực sự làm tăng nguy cơ lây truyền viêm gan C vì không có kháng thể sẵn có ở IVIGs để trung hoà bất cứ viêm gan C nào mà có thể làm cho nó thành một chế phẩm từ plasma dự trữ. Gần đây những người hiến máu tiếp xúc với viêm gan C có thể có virus huyết, nhưng không có kháng thể. FDA tuyên bố đầu năm 1995 là các nhà sản xuất cần cung cấp các tư liệu về bất hoạt virus hoặc các giai đoạn loại bỏ trong quá trình sản xuất, các nhà sản xuất Gamimuse N(r), Sandoglobulin (r), Iveegam (r); Gammagard SD (r), polygam SD (r) và venoglobulin-S (r) tất cả đã cung cấp các dữ liệu bất hoạt viêm gan C trong quá trình sản xuất. Hiện nay FDA sàng lọc tất cả các lô IVIGs về viêm gan C bằng các xét nghiệm phản ứng chuỗi polymerase trước khi chúng được ra đời. Bởi vậy, liệu sản phẩm điều chế dạng bột hoà tan có tăng chi phí giá trị của chúng có thể bị thất bại hay không.
Phản ứng có hại:nói chung IVIGs thường ít gây ra phản ứng có hại. Phản ứng liên quan đến truyền tĩnh mạch (đau đầu, đau lưng hoặc bụng, buồn nôn/nôn, ớn lạnh, sốt và đau cơ) có thể xử trí bằng giảm tốc độ truyền hoặc điều trị trước khi truyền bằng aspirin hoặc corticosteroid. Có phản ứng bất lợi nhưng hiếm ( viêm màng não vô khuẩn, viêm gan) liên quan đến IVIGs. năm 1994, thông tin về sản phẩm IVIGs biến đổi bao gồm cảnh báo về viêm màng não vô khuẩn. Hội chứng này thường sảy ra trong vòng một vài giờ tới 2 ngày sau khi điều trị. Đặc điểm là đau đầu rất nặng, cứng gáy, ngủ gà, sốt, sợ ánh sáng, đau khi nháy mắt và buồn nôn/nôn. Viêm màng não vô khuẩn do IVIGs nên được giải quyết trong vài ngày sau khi ngừng điều trị.
Sàng lọc lựa chọn người hiến máu và quá trình tách ethanol cho thấy ngăn ngừa nhiễm HIV cho IVIGs. Chưa thấy có trường hợp HIV nào liên quan đến sử dụng IVIGs.
Tóm tắt: IVIGs là chế phẩm của IgG dự trữ từ plasma người hiến máu được tinh chế và sử lý để có thể tiêm tĩnh mạch. IVIGs được sử dụng cho nhiều chỉ định gồm điều trị suy giảm miễn dịch tiên phát hoặc thứ phát, điều trị bệnh tự miễn và đặc tính ức chế miễn dịch. IVIGs có trên thị trường được xem như tương đương về tư liệu. Những số liệu hạn chế về sử dụng IVIGs cho bệnh tự miễn không dán trên nhãn lấy từ những thử nghiệm không đối chứng và một số thông báo. Tuy nhiên, có thể IVIGs đưa ra liệu pháp thay thế khi các thay thế ít chi phí đã thất bại hoặc trước những thủ thuật chi phí nhiều hơn như liệu pháp điều trị bằng huyết tương đã tinh chế. Tất cả các sản phẩm IVIGs hiện nay được xem như an toàn như nhau đối với lây truyền viêm gan C do khả năng bất hoạt viêm gan C được chỉ ra trong quá trình sản xuất. Lựa chọn sản phẩm chỉ quan trọng ở bệnh nhân đặc biệt (ví dụ ở bệnh nhân giảm gamma globulin huyết nhạy cảm với IgA).
(Theo cimsi)
Mới hơn
- LƯƠNG Y NGUYỄN BÁ NHO KHẮC TINH CỦA BỆNH UNG THƯ
- Thầy thuốc đến từ Đề án 1816 hiến máu cứu người bệnh
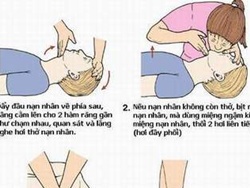
- Cách hô hấp nhân tạo và xoa bóp tim ngoài lồng ngực
- 65 năm chiến sĩ áo trắng
- Chiến thắng nỗi đau
- “Bắt bệnh” cho người chết
- “Giàng y tế” ở A Bung
- “Trái tim Đankô” của thầy thuốc làng HIV/AIDS
- Thần y trong nhà lao Côn Đảo
- Thành công từ ý chí và sự vươn lên không mệt mỏi
- Người bác sĩ giàu lòng nhân ái và sáng tạo
- Ở nơi “hạn hán nụ cười”
- Người Giàng
- “Hoa Đà” trên Cao nguyên đá
- Đông y và các bệnh thường gặp mùa lạnh
- Bệnh gút và điều trị gút trong đông y
- Bệnh nhồi máu cơ tim và bài thuốc chữa từ đông y
- Đông y điều trị rối loạn nhịp tim
- Chữa trĩ bằng Đông y
- Tự chữa bệnh trĩ bằng Đông y
- Đông y trị bệnh đau mắt đỏ
- Chữa trị rối loạn tiền đình theo Đông y
- Đông y trị chứng hoa mắt chóng mặt
- Khí công
- Mai hoa châm